4.2.3 Termodynamické procesy
Na opis rovnovážneho stavu sústavy častíc sa používajú
stavové veličiny, ktorých vzájomný súvis vyjadruje stavová rovnica.
V sústave prebiehajúce
procesy môžeme rozdeliť z hľadiska ich vratnosti na:
· reverzibilné ( vratné ) procesy - po prebehnutí takéhoto procesu sa sústava môže
sama, bez vonkajšieho vplyvu, dostať späť do východiskového stavu. Takým
procesom je napríklad veľmi pomalá expanzia plynu uzavretého v nádobe
s pohyblivou stenou. A potom opačný proces, veľmi pomalá kompresia tohoto
plynu do pôvodného stavu. Proces musí byť tak pomalý, že plyn sa dostáva
z počiatočného do konečného stavu a opačne sledom rovnovážnych stavov,
ktoré plyn dosahoval po nekonečne malých zmenách týchto rovnovážnych stavov.
·
ireverzibilné ( nevratné )
procesy - sústava sa nemôže sama, bez vonkajšieho vplyvu, dostať späť do
východzieho stavu. Príkladom takéhoto procesu môže byť prudké stlačenie alebo
expanzia plynu v nádobe.
Tieto procesy môžu
v prírode prebiehať za rôznych špecifických podmienok.
a) Opíšeme proces
prebiehajúci v sústave uzavretej v nádobe s konštantným objemom - izochorický dej. Všeobecne platí, že ak
dodáme sústave teplo dQ, toto teplo sa rozdelí na časť dU, ktorá spôsobí zvýšenie vnútornej
energie a časť 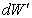 , ktorou vykoná plyn prácu. Teda platí
, ktorou vykoná plyn prácu. Teda platí

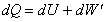 (4.2.3.1
)
(4.2.3.1
)
Elementárnu zmenu vnútornej
energie v tomto vzťahu, množstva n
mólov plynu pri zmene teploty o dT,
môžeme zapísať 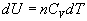 a plynom vykonanú prácu pri zmene objemu o dV vzťahom dW¢ = pdV. Potom prejde vzťah
4.2.3.1 do tvaru
a plynom vykonanú prácu pri zmene objemu o dV vzťahom dW¢ = pdV. Potom prejde vzťah
4.2.3.1 do tvaru
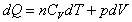 . (
4.2.3.2 )
. (
4.2.3.2 )
Za danej podmienky, že objem
je konštantný (V = konšt.) je zmena objemu nulová (dV = 0 ), teda aj práca vykonaná plynom
je nulová (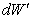 = 0 ). Potom sa teplo dodané sústave prejaví len zmenou
vnútornej energie. Ak ešte za látkové množstvo dosadíme
= 0 ). Potom sa teplo dodané sústave prejaví len zmenou
vnútornej energie. Ak ešte za látkové množstvo dosadíme
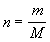 ,
,
vzťah 4.2.3.1 nadobudne tvary
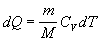
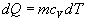
 (
4.2.3.3 )
(
4.2.3.3 )
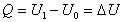 .
.
Poslednú rovnicu môžeme
slovne vyjadriť takto: Teplo dodané
sústave pri izochorickom deji spôsobí len zmenu jej vnútornej energie.
b) Proces prebiehajúci
v sústave pri konštantnej teplote - izotermický
proces.
Pri sledovaní tohoto procesu
budeme vychádzať zo vzťahu 4.2.3.2 .
Za danej podmienky, že
teplota je konštantná (T = konšt.) je zmena teploty nulová (dT = 0 ), teda aj zmena vnútornej
energie je nulová (dU = 0 ). Potom
teplo dodané sústave, sa prejaví ako práca plynu, ktorú vykoná pri svojej
expanzii. Rovnica 4.2.3.2 prejde do tvaru
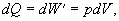
alebo
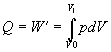 .
.
Ak za tlak plynu dosadíme upravenú
rovnicu Boylovho - Mariottovho zákona v tvare
 ,
,
platí
 .
.
Rovnica opisuje výpočet
práce pri známych zmenách hodnôt tlaku a objemu plynu.Túto prácu je možné
vypočítať využitím posledného vzťahu aj pri zadaní iných stavových veličín,
využitím vhodného tvaru stavovej rovnice. Napríklad
· 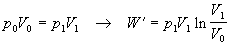 ,
,
·  ,
,
· 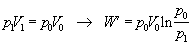 ,
,
a podobne.
c) Proces pri
konštantnom tlaku - izobarický proces.
Za danej podmienky, že tlak
je konštantný (p = konšt.) je aj jeho zmena nulová (dp = 0 ). Potom, teplo dodané sústave sa
prejaví zvýšením vnútornej energie a prácou, ktorú plyn vykoná pri svojej
expanzii. Rovnicu 4.2.3.2 môžeme napísať v tvare
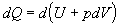 ,
,
alebo
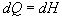 .
.
V poslednom vzťahu sme
označili H = U + pV, kde H sme
označili novozavedenú fyzikálnu veličinu nazvanú entalpia sústavy. Jeho integráciou dostaneme
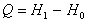 .
.
Slovne: Teplo prijaté sústavou za konštantného tlaku sa rovná prírastku
entalpie sústavy.
d) Proces prebiehajúci bez
výmeny tepla medzi sústavou a okolím -
adiabatický proces. V prírode sa vyskytujúce procesy, ktoré prebiehajú
dostatočne rýchlo môžeme považovať za adiabatické.
Za danej podmienky, že teplo
dodané sústave je nulové (dQ = 0 ),
rovnica 4.2.3.1 nadobúda tvar
 ,
,
alebo
 . (
4.2.3.4 )
. (
4.2.3.4 )
Nájdime teraz diferenciály oboch strán stavovej
rovnice pV = nRT za podmienky,
že n,R sú konštanty a vyjadrime
z nej diferenciál teploty
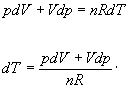
Dosadením do rovnice
4.2.3.4 za dT upravíme vzniknutý vzťah jednoduchými matematickými úpravami
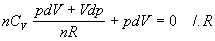
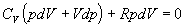
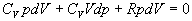
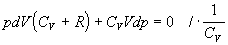
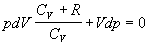
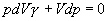 .
.
Poslednú úpravu sme vykonali
využitím platnosti rovnice
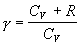 ,
,
paragraf 4.1.5. Ďalej vykonáme separáciu premenných a rovnicu zintegrujeme ako neurčitý integrál
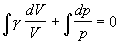
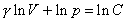 ,
,
kde ln C je zvolená integračná konštanta. Využijeme poznaty
z matematiky o odlogaritmovaní a dostávame
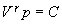 . (
4.2.3.5 )
. (
4.2.3.5 )
Vzťah 4.2.3.5 nazývame Poissonova rovnica. Udáva vzájomnú závislosť tlaku a objemu plynu
pri adiabatických zmenách.
Vzťah môžeme napísať aj
v nasledujúcom tvare
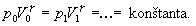
Grafickú závislosť tlaku a
objemu pri adiabatickom deji a na porovnanie aj pri izotermickom deji
znázorňuje obr. 4.2.3.4.

Príklad 4.2.3.1
Akú hmotnosť
má hélium ( molárna hmotnosť M =
4.10-3 kg.mol-1 ), ktoré sme zohriali dodaním tepla 209 J
z teploty 60 0C na 80 0C pri konštantnom objeme ?
Riešenie :
V súlade
so zadaním označíme Q = 209 J, t1 = 60 0C a t2 = 80
0C. Pre výpočet použijeme vzťah 4.2.3.3 v tvare
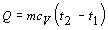 .
.
Úpravou
Mayerovho vzťahu 4.2.2.3 získame vzťah pre výpočet cV :

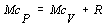
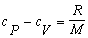
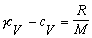
 .
.
Pri úprave sme
využili vzťah pre výpočet Poissonovej konštanty 4.1.14 . Po dosadení do
východzieho vzťahu dostávame :
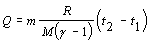 .
.
Vzťah matematicky
upravíme a dosadíme číselné hodnoty. Hodnotu Poissonovej konštanty vypočítame
využitím empirického vzťahu 4.1.14, pričom zo zadania príkladu vieme, že počet
stupňov voľnosti i = 3. Prevod
teploty z Celziovej na Kelvinovu sme urobili ako v príklade 4.2.1.2 .
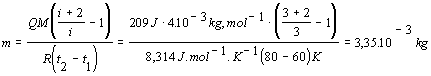 .
.
Za daných
podmienok sme zohriali 3,35.10-3 kg hélia.
