4.2.6 Entropia, druhá a tretia veta termodynamická
Pre účinnosť tepelného stroja, ktorého kruhový dej medzi
teplotami T1 a T2 (T2 < T1)
opisuje reverzibilný Carnotov cyklus, platí
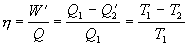 .
.
Ak označíme 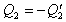 ,
,
potom
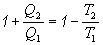 ,
,
alebo po matematickej úprave
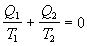 .
.
Ak podiel
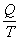
nazveme redukované teplo, vzťah môžeme vyjadriť slovami: Súčet redukovaných tepiel prijatých
sústavou počas reverzibilného Carnotovho cyklu sa rovná nule.
Poslednú rovnicu môžeme
zovšeobecniť aj na procesy, kedy sústava vratne prijíma teplo viac ako dvakrát
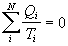 , (
4.2.6.1 )
, (
4.2.6.1 )
kde N je počet prijatí tepla.
Majme teraz reverzibilný
kruhový dej ako na obrázku 4.2.6.1. Plochu ohraničenú do seba uzavretou
krivkou k možno vymedziť
elementárnymi Carnotovými cyklami, ako napríklad cyklus ABCD. Pri konštantnej
teplote T1 sústava prijíma
teplo dQ1 a pri
konštantnej teplote T2
prijme teplo dQ2 .Aj pre
takýto elementárny Carnotov cyklus platí rovnica 4.2.6.1. Rovnicu môžeme
zovšeobecniť na všetky elementárne Carnotove cykly vytvorené na ploche
ohraničenej krivkou k , teda
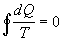 . (
4.2.6.2 )
. (
4.2.6.2 )
V rovnici je dQ teplo vratne prijaté pri teplote T a integrácia sa vzťahuje na celý
kruhový dej.
Sledujme kruhový reverzibilný
dej, ktorý prebehol medzi bodmi A a B po krivkách k1 a k2,
ako na obrázku 4.2.6.2 . Na základe platnosti rovnice 4.2.6.2, môžeme pre tento
kruhový dej rozpísať nasledovne
 ,
,
alebo
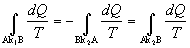 .
.
Na základe posledných
vzťahov môžeme usúdiť, že výsledok integrálu nezávisí od spôsobu ako sústava prešla zo základného stavu
A do stavu B, ale závisí len od týchto stavov. Ak označíme
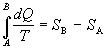 ,
,
potom veličinu S nazývame entropiou. Jednotkou entropie je joule na kelvin [J.K-1]. Jej diferenciál je
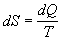 . (
4.2.6.3 )
. (
4.2.6.3 )
Ak prebehne v sústave
kruhový dej reverzibilne a sústava sa dostane do východzieho bodu, rovnicu (
4.2.6.3 ) môžeme prepísať do tvaru
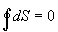 ,
,
ktorý je považovaný za
matematickú formuláciu druhej vety
termodynamickej.
Druhá veta termodynamická
umožnila entropiu S definovať
len ako funkciu stavu sústavy.
Pri sledovaní entropie adiabatických (dQ=0) reverzibilných dejov
zapíšeme zmenu entropie nasledovne
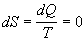 .
.
Pre entropiu pri zmene stavu sústavy z A do B potom
platí
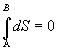 .
.
Po integrácii a matematickej
úprave
SB - SA = 0
SA = SB .
Posledý vzťah môžeme slovami
vyjadriť: Počas adiabatických
reverzibilných dejov sa entropia sústavy nemení.
Gibbs tieto vratné
adiabatické deje nazval izentropické
deje.
Vo
viacerých učebniciach fyziky by sme našli matematické postupy ktoré
dokazujú, že účinnosť tepelných strojov
založených na reverzibilnom Carnotovom cykle je najvyššia. Teda účinnosť
tepelných strojov založených na ireverzibilnom
deji je vždy menšia. Preto platí
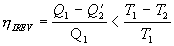 .
.
Ak označíme 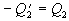
a rovnicu upravíme,
dostávame tvar
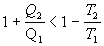
a po úprave
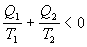 .
.
Poslednú rovnicu môžeme
zovšeobecniť aj na proces, kedy sústava prijíma teplo viackrát
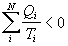 ,
,
kde N je počet prijatí tepla. A pre ireverzibilný kruhový dej
prebiehajúci spojite platí
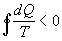 .
.
Majme teraz ireverzibilný
kruhový dej prebiehajúci medzi bodmi A a B ako na obrázku 4.2.6.3. Dej prebieha
z bodu B do bodu A po krivke k1 reverzibilne
a z bodu A do B po krivke k2 ireverzibilne.
Pre tento dej platí
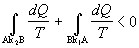 .
.
Po úprave integračných
hraníc môžeme napísať
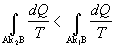 . (
4.2.6.4 )
. (
4.2.6.4 )
Z predchádzajúcich
poznatkov o narastaní entropie pre reverzibilné deje platí
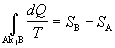
a s použitím vzťahu
4.2.6.4 prechádza posledná rovnica do tvaru
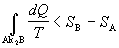 .
.
Pri sledovaní entropie
adiabatických (dQ = 0)
ireverzibilných dejov potom môžeme písať
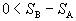 ,
,
alebo
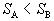 .
.
Posledný vzťah môžeme
slovami vyjadriť nasledovne: Pri
všetkých ireverzibilných dejoch prebiehajúcich v sústavách od okolia
tepelne izolovaných sa entropia sústavy zväčšuje.
Sústavou pokusov pri teplotách T® 0 sa zistilo, že
niektoré vlastnosti látok ( elektrický odpor vodičov, teplotná rozťažnosť,
molárna tepelná kapacita) nie sú závislé od teploty. Alebo opačne - zmenou
žiadnych vonkajších parametrov látky pri teplote T® 0 nemožno dosiahnuť
zníženie teploty na T = 0 . Túto
skutočnosť Planck vyjadril vetou:
Čistú tuhú látku nie je možné konečným procesom
ochladiť na nulovú Kelvinovu teplotu.
Je pravdepodobné, že
v blízkosti teploty T = 0
prestáva tepelný pohyb častíc, čiže aj už existujúce nerovnovážne stavy
v sústave môžu existovať ľubovolne dlho. Tieto poznatky zovšeobecnil Nernst v tretej vete termodynamickej.
Jej znenie je:
Pre ľubovoľný izotermický dej prebiehajúci pri
teplote T® 0 je zmena entropie nulová. Vetu doplnil Planck tým, že
položil entropiu pri teplote T® 0 rovnú nule S(T=0)
= 0. Tým odstránil neurčitosť v určení absolútnej hodnoty
entropie každého stavu látky.
Príklad 4.2.6.1
Aká je zmena
entropie 1 kg vodnej pary zohriatej na 100 0C vzhľadom na stav
v kvapalnom skupenstve pri teplote 20 0C ? Hmotnostná tepelná
kapacita vody je cv =
4186 J.kg-1. K-1 a skupenské teplo vyparovania vody lv =
2,256.106 J.kg-1.
Riešenie :
Sledovanú
zmenu entropie môžeme rozdeliť na dve časti. Zmena entropie m = 1kg vody pri jej zohriatí
z teploty tA = 20 0C Þ TA = 293,15 K na bod
varu tB = 100 0C Þ TB = 373,15 K a zmenu
entropie vody počas jej premeny na paru pri konštantnej teplote tB . Celkovú zmenu entropie
zapíšeme
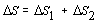 .
.
Pre výpočet
jednotlivých zmien entropie použijeme vzťah 4.2.6.3 a dosadíme
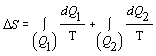 .
.
Proces
zohrievania vody z teploty TA
na TB opíšeme rovnicou dQ1 = mcV dT a vyparenie vody rovnicou dQ2 = lV dm. Pritom
nesmieme zabudnúť, že vyparovanie sa deje pri konštantnej teplote TB. Za týchto podmienok zmenu
entropie vypočítame
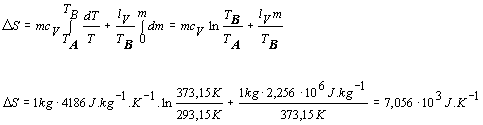
 Zmena entropie vodnej pary je 7,056.103
J.K -1 .
Zmena entropie vodnej pary je 7,056.103
J.K -1 .