13.2.2
Atóm
vodíka
Atóm vodíka je najjednoduchší atóm, skladajúci sa z jedného elektrónu a jedného
protónu, viazanými elektrostatickou interakciou. Z experimentov bolo
známe, že atóm nežiari, ak sa
nachádza v základnom stave, t.j. v stave s najnižšou
energiou. Ak však zvýšime jeho vnútornú energiu, atóm sa dostane do excitovaného stavu, t.j. do stavu s energiou nad
základným stavom. Atóm v excitovanom stave vysiela žiarenie.
13.2.2.1 Bohrov model atómu
Na sklonku devätnásteho storočia bolo zistené, že spektrum atómov môže byť
tvorené radom diskrétnych hodnôt frekvencií, vtedy hovoríme o čiarovom spektre. Najjednoduchšie spektrum odpovedá
atómu vodíka. Spektrálne čiary v atómových spektrách nie sú rozložené náhodile,
ale sa radia do istých skupín, nazývaných spektrálne série. Vlnové dĺžky prislúchajúce jednotlivým pozorovaným čiaram v každej sérii, možno
určiť jednoduchým empirickým vzorcom, pričom je nápadná podobnosť medzi
jednotlivými vzorcami pre rôzne série,
ktoré obsahujú úplné spektrum uvažovaného prvku.

Prvá takáto séria,
objavená vo viditeľnej časti spektra atómu vodíka a pozostávajúca zo štyroch čiar (obr. 13.2.2.1), sa nazýva Balmerova
séria, podľa švajčiarskeho
vedca, ktorý v roku 1885 vyjadril vlnové dĺžky tejto série vzorcom
![]() (13.2.2.1)
(13.2.2.1)
kde C je určitá
konštanta a s = 3, 4, ... . Neskoršie
Rydberg zistil, že Balmerov vzorec možno upraviť, po zavedení vlnočtu![]() n =1/l , na tvar
n =1/l , na tvar
![]() (13.2.2.2)
(13.2.2.2)
kde R je Rydbergova konštanta (resp.
vlnočet ) pre vodík, ktorej
hodnota je
R = 10 973 730 m-1 . (13.2.2.3)
Postupne boli v spektre vodíka zistené i ďalšie série a to
v infračervenej i v ultrafialovej oblasti spektra (obr. 13.2.2.2).

Vysvetliť pozorované čiarové
spektrá atómu vodíka sa podarilo dánskemu fyzikovi Nielsovi Bohrovi (1885-1962), na
základe poznatkov týkajúcich matematického vyjadrenia vlnočtov
spektrálnych sérií [Balmerov (13.2.2.1) resp. Rydbergov vzorec (13.2.2.2)], poznatkov Planckovej
teórie žiarenia zahriatych telies a Einsteinovej teórie fotoefektu.
Teóriu atómu vodíka zhrnul
do troch postulátov:
·
1. Bohrov postulát stacionárnych stavov
Atómy môžu existovať v istých
stacionárnych stavoch, v ktorých nevyžarujú energiu. Tieto stacionárne
stavy korešpondujú „orbitám“ v klasickej predstave pohybujúcich sa
elektrónov okolo jadra, obdobne ako
predpokladal planetárny model atómu. Elektróny na týchto orbitách
neemitujú elektromagnetické žiarenie i napriek
tomu, že konajú pohyb so zrýchlením.
·
2.
Bohrov postulát kvantovania orbitálnych dráh
Celkový orbitálny moment hybnosti elektrónu ln nachádzajúceho sa na stacionárnej orbite sa rovná celočíselnému násobku Planckovej konštanty h, resp. redukovanej Planckovej konštanty ħ = h/2p ( nazvanej hatrans).
![]() (13.2.2.4 )
(13.2.2.4 )
kde rn
je polomer n-tej kruhovej dráhy
(orbity) a n je prirodzené číslo.
·
3. Bohrov postulát frekvenčnej podmienky
Atóm emituje kvantum elektromagnetického
žiarenia (fotón), keď elektrón preskočí z kvantovej dráhy s kvantovým
číslom m na kvantovú dráhu s menším číslom n . Energia fotónu je
určená rozdielom energií na kvantovej dráhe pred a po vyžiarení:
E = hf = Em - En .
(13.2.2.5)
Bohrove postuláty nemožno odvodiť z klasickej fyziky. Možno ich vysvetliť len na základe kvantovej mechaniky. Bohrov model určuje:
1/ vzťah pre energiu elektrónu na stacionárnej dráhe v atóme
vodíka
![]() (13.2.2.6)
(13.2.2.6)
kde e0 je permitivita vákua, me
hmotnosť elektrónu, Z je protónové číslo a n hlavné
kvantové číslo. (Pre
atóm vodíka platí Z = 1.)
Pre základný stav (n =1) možno určiť energiu základného
stavu E1, ktorá má hodnotu
E1= – 13,6 eV.
Poznámka: Rovnica (13.2.2.6 -13.2.2.8) platí aj pre atómu vodíka
podobné atómy, t.j. ionizované atómy, ktoré majú 1 valenčný elektrón, ako
napr. Li+...
2/ polomer n-tej
kruhovej dráhy
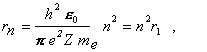 (13.2.2.7)
(13.2.2.7)
odvodený z podmienky, že dostredivá sila je spôsobená coulombickým
priťahovaním elektrónu k jadru: t.j. platí ½fd½ = ½fc½
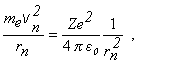 (13.2.2.8)
(13.2.2.8)
s využitím kvantovej podmienky vzťah (13.2.2.4).
Polomer orbity s hlavným kvantovým číslom n = 1 sa nazýva
Bohrov polomer, r1 =
0,529177249 .10-10 m.
3/ frekvencie v čiarovom spektre vodíka
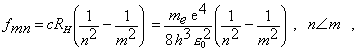 (13.2.2.9)
(13.2.2.9)
kde c je
rýchlosť svetla , RH
Rydbergova konštanta pre H-atóm a
n, m sú prirodzené čísla.
RH =
1,0967758.107 m-1. Ak m =µ
dostávame hranu série pre dané n.
Potvrdenie správnosti Bohrovho modelu :
·
pomerne dobrý súhlas hodnoty
Rydbergovej konštanty RH, určenej zo spektier a vypočítanej z Bohrovho modelu R¥. Nepatrný rozdiel vyplýva z predpokladu nehybného
jadra (t.j. nekonečne ťažkého jadra).
Ak zvážime, že protón má konečnú hmotnosť, je nutné do vzťahu miesto
hmotnosti elektrónu me dosadiť redukovanú
hmotnosť mred ,
definovanú vzťahom
![]()
![]()
·
Franckov a Hertzov pokus, uskutočnený v roku 1913, ktorý
experimentálne dokázal existenciu diskrétnych energetických hladín urýchľovaním
elektrónov atómov ortuti vo vákuovej
trubici.
––––––––––––––––––––––––––––––––-
Príklad 13.2.2.1
Na základe Bohrovej teórie atómu vodíka
odvoďte vzťah pre polomer dráhy,
rýchlosť na n-tej kvantovej dráhe
v atóme vodíka. Určite hodnoty uvedených
veličín pre tretiu
kvantovú dráhu.
Riešenie: Na základe Bohrovej teórie sa elektrón pohybuje po dovolených kruhových orbitách okolo jadra pod vplyvom Coulombovej príťažlivej sily medzi elektrónom a kladne nabitým jadrom. Podmienkou pre stabilitu pohybu je rovnosť veľkosti sily dostredivej a elektrostatickej , t.j. platí rovnica (13.2.2.8)
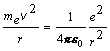 (1)
(1)
Dovolené orbity sú určené kvantovou podmienkou (13.2.2.4) mv rn = n h/2p . Ak si z uvedených rovníc vyjadríme kvadrát rýchlosti, resp. rýchlosť, dostaneme nasledovné rovnice
![]() ,
(2)
,
(2)
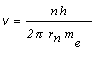 . (3)
. (3)
Umocnením rovnice (3) na druhú a porovnaním obidvoch pravých strán rovníc (2) a (3) dostávame vzťah (13.2.2.7) pre polomer dráhy
![]() . (4)
. (4)
V prípade n = 3 pre číselnú hodnotu polomeru tretej orbity dostaneme rn = 47,619.10-11 m. Obvodovú rýchlosť elektrónu na n-tej dráhe určíme z kvantovej podmienky (13.2.2.4)
![]() ,
(5)
,
(5)
po dosadení za polomer z rovnice (4) a následných úpravách dostávame
![]()
![]()
a dosadení číselných hodnôt určíme obvodovú rýchlosť elektrónu na tretej sfére
v 3 = 7,2.105 m. s-1.
––––––––––––––––––––––
Príklad 13.2.2.2 Vypočítajte frekvenciu žiarenia potrebného na excitáciu elektrónu vo vodíkovom atóme zo základného stavu do najbližšieho excitovaného stavu.
Riešenie: Druhý Bohrov postulát ukazuje, že ak elektrón preskočí z jednej dovolenej orbity s hlavným kvantovým číslom nm na druhú orbitu s hlavným kvantovým číslom nn , (m > n) emituje fotón frekvencie fmn určenej vzťahom (13.2.2.9)

resp. fotón s vlnovou dĺžkou l určenou rovnicou
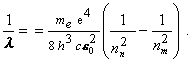
Keďže chceme dosiahnuť prechod z prvého
excitovaného stavu nm =2 do základného stavu s nn
=1 musíme atóm ožiariť s frekvenciou f
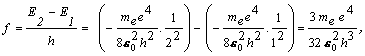
resp. jednoduchšie ak uvážime, že E1 = -13,6 eV a E2 = E1/4 , pre f dostaneme
f =( E2 - E1)/h = 3(13.6 eV)/4h =2,466.1015 Hz .
–––––––––––––––––––––––––
Príklad 13.2.2.3
Vypočítajte frekvenciu žiarenia potrebného na
ionizáciu atómu vodíka v základnom stave. Akú „farbu“ budú mať
tieto fotóny? Porovnajte ich s „farbou“ žiarenia potrebného na excitáciu do
prvej vzbudenej hladiny. (Pozri príklad 13.2.2.2).
Riešenie: Aby došlo k ionizácií atómu vodíka, musíme elektrónu dodať energiu, ktorá sa rovná½E1½, t.j. 13,6 eV Vtedy sa elektrón uvoľní z atómu. Frekvenciu žiarenia, spôsobujúceho ionizáciu atómu vodíka určuje vzťah (13.2.2.9) , kde sme dosadili n n= 1 a nm =µ
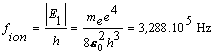
„Farba“ fotónom je priradená iba vo viditeľnej oblasti elektromagnetického spektra. Zistíme odpovedajúce vlnové dĺžky žiarenia, spôsobujúce ionizáciu i emisiu z prvej excitovanej hladiny na základnú. Prepočítaním cez rýchlosť svetla dostaneme vlnové dĺžky a to
![]() ,
,
![]()
„Farbu “ fotónom nemôžeme priradiť, keďže v obidvoch prípadoch vlnové dĺžky spadajú do ultrafialovej oblasti.
Príklad 13.2.2.4 Na základe Bohrovho modelu atómu odvoďte vzťah pre celkovú energiu elektrónu v atóme vodíka nachádzajúceho
sa na kruhovej dráhy s hlavným
kvantovým číslom n.
Riešenie:
Celkovú energiu si vyjadríme ako súčet kinetickej a potenciálnej energie
elektrónu na orbite s hlavným kvantovým číslom n.
En = Ekn
+Epn .
Ekn určíme na základe vzťahu (2) z príkladu
13.2.2.1. Pre potenciálnu energiu v poli jadra s nábojom Ze
v mieste s rn
dostávame
![]()
![]()
Po
dosadení vzťahu (4) z príkladu 13.2.2.1 za polomer rn, dostaneme pre celkovú energiu

–––––––––––––––––––––––––––––––––––-
Kontrolné otázky
1.
Dokážte
súvislosť medzi Rydbergovou konštantou vystupujúcou v Rydbergovej rovnici (13.2.2.2) a konštantou, nachádzajúcou
sa vo vzťahu pre diskrétne hodnoty energie
(13.2.2.6) atómu vodíka.
2.
Definujte
pojem „redukovaná hmotnosť“.
3.
Zmenia sa
energetické hladiny atómu vodíka, ak
pohyb jadra nezanedbávame? Ak áno, ako?
4.
Napíšte
vzťah pre vlnové dĺžky prechodov v Lymannovej sérii.
5.
Aké série
boli pozorované v infračervenej oblasti spektra?
6.
Vo
viditeľnej časti spektra atómu vodíka boli pozorované spektrálne čiary. Ich vlnovú dĺžku možno určiť na základe
matematického vzťahu. Napíšte tento vzťah a meno objaviteľa tejto série.
7.
Definujte
pojem hrana série.
8.
Definujte
pojem základný stav atómu.
9.
Vysvetlite
pojem „excitovaný stav atómu“.
10.
Aká energia,
vyjadrená v eV, prináleží základnému stavu atómu vodíka?
11.
Vyjadrite
energiu elektrónu v atóme vodíka ako funkciu hlavného kvantového
čísla a energie základného stavu.
12.
Vyjadrite
periódu obehu elektrónu v atóme vodíka, ako funkciu hlavného kvantového
čísla.
13.
Vyjadrite
potenciálnu a kinetickú energiu elektrónu na orbite s hlavným kvantovým číslom n ako funkciu polomeru tejto dráhy, resp. ako funkciu hlavného kvantového čísla.
14.
V akom
vzťahu je Planckova konštanta k redukovanej Planckovej konštante
(hatrans)?
15.
Vysvetlite
pojem Bohrov polomer a určite jeho veľkosť.
16.
Napíšte
vzťah určujúci polomer n-tej dráhy ako funkciu Bohrovho polomeru
a hlavného kvantového čísla.
17.
Zistite, či sa prekrývajú niektoré z prvých
šiestich energetických hladín elektrónu
v atóme ionizovaného hélia He+ s energetickými hladinami
elektrónu v atóme vodíka.