7.2.6
Entropia, druhá a
tretia veta termodynamická
Pre
účinnosť tepelného stroja, ktorého kruhový dej medzi teplotami T1 a T2 (T2< T1) opisuje reverzibilný
Carnotov cyklus, platí
![]() .
.
Ak označíme ![]() , potom
, potom
![]() ,
,
alebo po matematickej úprave
![]() .
.
Ak podiel Q /T nazveme redukované
teplo, vzťah môžeme vyjadriť slovami: Súčet
redukovaných tepiel prijatých sústavou počas reverzibilného Carnotovho cyklu sa
rovná nule.
Poslednú rovnicu môžeme zovšeobecniť aj na procesy,
kedy sústava vratne prijíma teplo viac ako dvakrát
![]() , (
7.2.6.1 )
, (
7.2.6.1 )
kde N je
počet prijatí tepla.
|
|
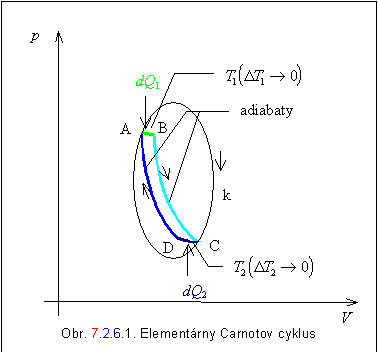
Majme teraz reverzibilný kruhový dej ako na obrázku
7.2.6.1. Plochu ohraničenú do seba uzavretou krivkou k možno vymedziť elementárnymi Carnotovými cyklami, ako
napríklad cyklus ABCD. Pri konštantnej teplote T1 sústava prijíma teplo dQ1 a pri konštantnej teplote T2 prijme teplo dQ2
.Aj pre takýto elementárny Carnotov cyklus platí rovnica 7.2.6.1. Rovnicu
môžeme zovšeobecniť na všetky elementárne Carnotove cykly vytvorené na ploche
ohraničenej krivkou k , teda
![]() . (
7.2.6.2 )
. (
7.2.6.2 )
V rovnici je
dQ teplo vratne prijaté pri teplote T
a integrácia sa vzťahuje na celý kruhový dej.
|
|
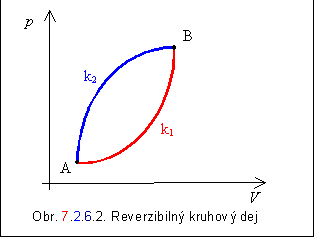
Sledujme kruhový reverzibilný dej, ktorý prebehol
medzi bodmi A a B po krivkách k1 a k2, ako na obrázku
7.2.6.2 . Na základe platnosti rovnice 7.2.6.2, môžeme pre tento kruhový dej
rozpísať nasledovne
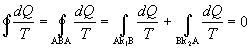 ,
,
alebo
![]() .
.
Na základe posledných vzťahov môžeme usúdiť, že
výsledok integrálu nezávisí od spôsobu ako
sústava prešla zo základného stavu A do stavu B, ale závisí len od týchto
stavov. Ak označíme
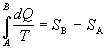 ,
,
potom veličinu S nazývame
entropiou. Jednotkou entropie je joule na
kelvin [J.K-1]. Jej diferenciál je
![]() . (
7.2.6.3 )
. (
7.2.6.3 )
Ak prebehne v sústave kruhový dej reverzibilne
a sústava sa dostane do východzieho bodu, rovnicu (7.2.6.3 ) môžeme prepísať do
tvaru
![]() ,
,
ktorý je považovaný za matematickú formuláciu druhej vety termodynamickej.
Druhá veta termodynamická umožnila entropiu S definovať len ako funkciu stavu
sústavy.
Pri sledovaní entropie adiabatických (dQ=0) reverzibilných dejov zapíšeme zmenu entropie
nasledovne
![]() .
.
Pre entropiu pri
zmene stavu sústavy z A do B potom platí
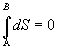 .
.
Po integrácii a matematickej úprave
SB - SA = 0
SA = SB .
Posledý vzťah môžeme slovami vyjadriť: Počas adiabatických reverzibilných dejov sa entropia
sústavy nemení.
Gibbs tieto vratné adiabatické deje nazval izentropické deje.
Vo viacerých učebniciach
fyziky by sme našli matematické postupy ktoré dokazujú, že účinnosť tepelných strojov založených na
reverzibilnom Carnotovom cykle je najvyššia. Teda účinnosť tepelných strojov
založených na ireverzibilnom deji je vždy
menšia. Preto platí
![]() .
.
Ak označíme ![]() a rovnicu upravíme,
dostávame tvar
a rovnicu upravíme,
dostávame tvar
![]()
a po úprave
![]() .
.
Poslednú rovnicu môžeme zovšeobecniť aj na proces,
kedy sústava prijíma teplo viackrát
![]() ,
,
kde N je
počet prijatí tepla. A pre ireverzibilný kruhový dej prebiehajúci spojite platí
![]() .
.
|
|
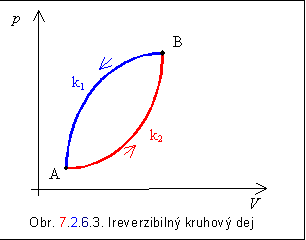
Majme teraz ireverzibilný kruhový dej prebiehajúci
medzi bodmi A a B ako na obrázku 7.2.6.3. Dej prebieha z bodu B do bodu A
po krivke k1 reverzibilne
a z bodu A do B po krivke k2 ireverzibilne.
Pre tento dej platí
![]() .
.
Po úprave integračných hraníc môžeme napísať
![]() . (
7.2.6.4 )
. (
7.2.6.4 )
Z predchádzajúcich poznatkov o narastaní
entropie pre reverzibilné deje platí
![]()
a s použitím vzťahu 7.2.6.4 prechádza posledná
rovnica do tvaru
![]() .
.
Pri sledovaní entropie adiabatických (dQ = 0) ireverzibilných dejov potom
môžeme písať
![]() ,
,
alebo
![]() .
.
Posledný vzťah môžeme slovami vyjadriť nasledovne: Pri všetkých ireverzibilných dejoch prebiehajúcich
v sústavách od okolia tepelne izolovaných sa entropia sústavy zväčšuje.
Sústavou
pokusov pri teplotách T® 0
sa zistilo, že niektoré vlastnosti látok ( elektrický odpor vodičov, teplotná
rozťažnosť, molárna tepelná kapacita) nie sú závislé od teploty. Alebo opačne -
zmenou žiadnych vonkajších parametrov látky pri teplote T® 0 nemožno dosiahnuť zníženie
teploty na T = 0 . Túto skutočnosť Planck vyjadril vetou:
Čistú tuhú látku nie je možné konečným
procesom ochladiť na nulovú Kelvinovu teplotu.
Je pravdepodobné, že v blízkosti teploty T = 0 prestáva tepelný pohyb častíc,
čiže aj už existujúce nerovnovážne stavy v sústave môžu existovať
ľubovolne dlho. Tieto poznatky zovšeobecnil Nernst v tretej vete termodynamickej. Jej znenie je:
Pre ľubovoľný izotermický dej
prebiehajúci pri teplote T® 0 je zmena
entropie nulová. Vetu doplnil Planck tým, že položil entropiu pri teplote T® 0 rovnú nule S(T=0) = 0. Tým odstránil
neurčitosť v určení absolútnej hodnoty entropie každého stavu látky.
![]()
Príklad 7.2.6.1
Aká je
zmena entropie 1 kg vodnej pary zohriatej na 100 0C vzhľadom na stav
v kvapalnom skupenstve pri teplote 20 0C ? Hmotnostná tepelná
kapacita vody je cV = 4186 J. kg-1.K-1 a skupenské teplo vyparovania vody lV = 2,256.106 J. kg-1.
Riešenie :
Sledovanú zmenu entropie môžeme rozdeliť na dve časti. Zmena entropie m = 1kg vody pri jej zohriatí z teploty tA = 20 0C Þ TA = 293,15 K na bod varu tB = 100 0C Þ TB = 373,15 K a zmenu entropie vody počas jej premeny na paru pri konštantnej teplote tB . Celkovú zmenu entropie zapíšeme
![]() .
.
Pre výpočet jednotlivých zmien entropie použijeme vzťah 7.2.6.3 a dosadíme
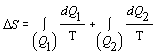 .
.
Proces zohrievania vody z teploty TA na TB opíšeme rovnicou dQ1 = mcV dT a vyparenie vody rovnicou dQ2 = lV dm. Pritom nesmieme zabudnúť, že vyparovanie sa deje pri konštantnej teplote TB. Za týchto podmienok zmenu entropie vypočítame
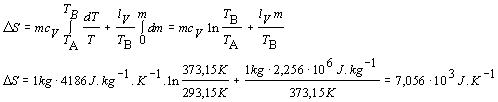
![]() Zmena
entropie vodnej pary je 7,056.103 J.K -1 .
Zmena
entropie vodnej pary je 7,056.103 J.K -1 .
Kontrolné otázky
- Čo hovorí kruhový
integrál vo vzťahu 7.2.6.2?
- Aký je význam druhej
vety termodynamickej vo vzťahu k entropii?
- Aké sú to izentropické
deje?
- Aký je vzťah medzi
účinnosťou reverzibilných a ireverzibilných kruhových dejov?
- Aký bol Planckov
príspevok k formulácii tretieho termodynamického zákona?
- Ako sa zmení entropia
liatinového odliatku s hmotnosťou 2t,
ak ho ochladíme z 10000C na 500C. Hmotnostná
tepelná kapacita liatiny je 544J.kg
-1.K -1. ( Ds= -1492kJ.K -1 )
- O koľko sa zmení entropia 0,1kg ľadu teploty -50C, ak sa zmení na vodu 0 0C teplú.Hmotnostná tepelná kapacita ľadu je 2090J.kg -1.K -1, hmotnostné skupenské teplo topenia ľadu je 333,6.103 J.kg-1. ( Ds=126J.K -1)