7.2.3 Termodynamické
procesy
Na
opis rovnovážneho stavu sústavy častíc sa používajú stavové veličiny, ktorých
vzájomný súvis vyjadruje stavová rovnica.
V sústave prebiehajúce procesy môžeme rozdeliť
z hľadiska ich vratnosti na:
·
reverzibilné ( vratné ) procesy - po prebehnutí takéhoto
procesu sa sústava môže sama, bez vonkajšieho vplyvu, dostať späť do
východiskového stavu. Takým procesom je napríklad veľmi pomalá expanzia plynu
uzavretého v nádobe s pohyblivou stenou. A potom opačný proces, veľmi
pomalá kompresia tohoto plynu do pôvodného stavu. Proces musí byť tak pomalý,
že plyn sa dostáva z počiatočného do konečného stavu a opačne sledom
rovnovážnych stavov, ktoré plyn dosahoval po nekonečne malých zmenách týchto
rovnovážnych stavov.
· ireverzibilné ( nevratné ) procesy - sústava sa nemôže sama, bez vonkajšieho vplyvu, dostať späť do východzieho stavu. Príkladom takéhoto procesu môže byť prudké stlačenie alebo expanzia plynu v nádobe.
Tieto procesy môžu v prírode prebiehať za
rôznych špecifických podmienok.
a)
Opíšeme
proces prebiehajúci v sústave uzavretej v nádobe s konštantným
objemom - izochorický dej. Všeobecne
platí, že ak dodáme sústave teplo dQ, toto teplo sa rozdelí na časť dU, ktorá spôsobí zvýšenie vnútornej
energie a časť ![]() , ktorou vykoná plyn prácu. Teda platí
, ktorou vykoná plyn prácu. Teda platí
![]() (7.2.3.1 )
(7.2.3.1 )
Elementárnu zmenu vnútornej energie v tomto
vzťahu, množstva n mólov plynu pri
zmene teploty o dT, môžeme zapísať ![]() a plynom vykonanú prácu pri zmene objemu o dV vzťahom dW¢ = pdV. Potom prejde vzťah 7.2.3.1
do tvaru
a plynom vykonanú prácu pri zmene objemu o dV vzťahom dW¢ = pdV. Potom prejde vzťah 7.2.3.1
do tvaru
![]() . (
7.2.3.2 )
. (
7.2.3.2 )
Za danej podmienky, že objem je konštantný (V = konšt.) je zmena objemu nulová (dV
= 0 ), teda aj práca vykonaná plynom je nulová (dW¢ = 0 ). Potom sa teplo dodané
sústave prejaví len zmenou vnútornej energie. Ak ešte za látkové množstvo
dosadíme
![]() ,
,
vzťah 7.2.3.1
nadobudne tvary
![]()
![]()
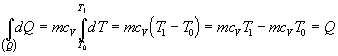 (
7.2.3.3 )
(
7.2.3.3 )
![]() .
.
|
|
Poslednú rovnicu môžeme slovne vyjadriť takto: Teplo dodané sústave pri izochorickom deji spôsobí len
zmenu jej vnútornej energie.
b) Proces prebiehajúci
v sústave pri konštantnej teplote - izotermický proces.
Pri sledovaní tohoto procesu budeme vychádzať zo
vzťahu 7.2.3.2 .
Za danej podmienky, že teplota je konštantná (T = konšt.) je zmena teploty nulová (dT
= 0 ), teda aj zmena vnútornej energie je nulová (dU = 0 ). Potom teplo dodané sústave, sa prejaví ako práca plynu,
ktorú vykoná pri svojej expanzii. Rovnica 7.2.3.2 prejde do tvaru
![]()
alebo
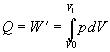 .
.
Ak za tlak plynu dosadíme upravenú rovnicu Boylovho
- Mariottovho zákona v tvare
![]() , platí
, platí
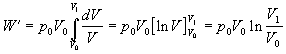 .
.
Rovnica opisuje výpočet práce pri známych zmenách
hodnôt tlaku a objemu plynu.Túto prácu je možné vypočítať využitím posledného
vzťahu aj pri zadaní iných stavových veličín, využitím vhodného tvaru stavovej
rovnice. Napríklad
· ![]() ,
,
· ![]() ,
,
· ![]() ,
,
a podobne.
|
|
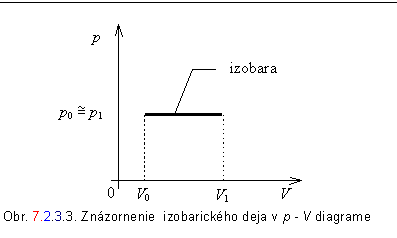
c)
Proces
pri konštantnom tlaku - izobarický proces.
Za danej podmienky, že tlak je konštantný (p = konšt.) je aj jeho zmena nulová (dp
= 0 ). Potom, teplo dodané sústave sa prejaví zvýšením vnútornej energie a
prácou, ktorú plyn vykoná pri svojej expanzii. Rovnicu 7.2.3.2 môžeme napísať
v tvare
![]() ,
,
alebo
![]() .
.
V poslednom vzťahu sme označili H = U + pV, kde H
sme označili novozavedenú fyzikálnu veličinu nazvanú
entalpia sústavy. Jeho integráciou dostaneme
![]() .
.
Slovne: Teplo prijaté
sústavou za konštantného tlaku sa rovná prírastku entalpie sústavy.
|
|
d) Proces prebiehajúci bez výmeny tepla medzi
sústavou a okolím - adiabatický proces.
V prírode sa vyskytujúce procesy, ktoré prebiehajú dostatočne rýchlo
môžeme považovať za adiabatické.
Za danej podmienky, že teplo dodané sústave je
nulové (dQ = 0 ), rovnica 7.2.3.1
nadobúda tvar
![]() ,
,
alebo
![]() . (
7.2.3.4 )
. (
7.2.3.4 )
Nájdime
teraz diferenciály oboch strán stavovej rovnice pV = nRT za podmienky, že n,R sú konštanty a vyjadrime z nej diferenciál teploty
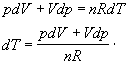
Dosadením do rovnice 7.2.3.4 za dT
upravíme vzniknutý vzťah jednoduchými matematickými úpravami
![]()
![]()
![]()
![]()
![]()
![]() .
.
Poslednú úpravu sme vykonali využitím platnosti
rovnice
![]() ,
,
paragraf 7.1.5. Ďalej vykonáme separáciu premenných
a rovnicu zintegrujeme ako neurčitý
integrál
![]()
![]() ,
,
kde lnC je
zvolená integračná konštanta. Využijeme poznaty z matematiky o
odlogaritmovaní a dostávame
![]() . (
7.2.3.5 )
. (
7.2.3.5 )
Vzťah 7.2.3.5
nazývame Poissonova rovnica. Udáva
vzájomnú závislosť tlaku a objemu plynu pri adiabatických zmenách.
Vzťah môžeme napísať aj v nasledujúcom tvare
![]() konštanta .
konštanta .
|
|
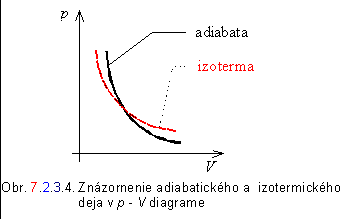
Grafickú závislosť tlaku a objemu pri adiabatickom
deji a na porovnanie aj pri izotermickom deji znázorňuje obr. 7.2.3.4.
![]()
Príklad 7.2.3.1
Akú
hmotnosť má hélium ( molárna hmotnosť M
= 4.10-3 kg.mol-1 ), ktoré sme zohriali dodaním tepla 209
J z teploty 60 0C na 80 0C pri konštantnom objeme ?
Riešenie :
V súlade so zadaním označíme Q = 209 J, t1 = 60 0C a t2 = 80 0C. Pre výpočet použijeme vzťah 7.2.3.3 v tvare
![]() .
.
Úpravou Mayerovho vzťahu 4.2.2.3 získame vzťah pre výpočet cV :
![]()
![]()
![]()
![]()
![]() .
.
Pri úprave sme využili vzťah pre výpočet Poissonovej konštanty 7.1.14 . Po dosadení do východzieho vzťahu dostávame :
![]() .
.
Vzťah matematicky upravíme a dosadíme číselné hodnoty. Hodnotu Poissonovej konštanty vypočítame využitím empirického vzťahu 7.1.14, pričom zo zadania príkladu vieme, že počet stupňov voľnosti i = 3. Prevod teploty z Celziovej na Kelvinovu sme urobili ako v príklade 7.2.1.2 .
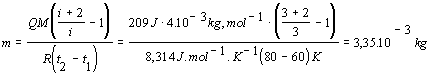 .
.
Za daných podmienok sme zohriali 3,35.10-3 kg hélia.
![]()
Kontrolné otázky
1. Aký je rozdiel medzi reverzibilným a ireverzibilným
procesom?
2. Prečo pri izochorickom deji plyn prácu nemôže konať?
3. Čo nazývame entalpiou sústavy?
4. Aká je fyzikálna jednotka entalpie?
5. Akú rovnicu by ste považovali pri izotermickom deji za
ekvivalent Poissonovej rovnice pri adiabatickom deji?
6. Izobaricky zohrejme 5kg
oxidu uhličitého z 10°C tak, aby počas rozpínania vykonal prácu
49050J. Na akú výslednú teplotu sa
plyn zohreje? Molárna hmotnosť oxidu uhličitého je 44.10 -3 kg.mol
-1. (T=334,9K)
7. Do nádoby s pevnými stenami umiestnime 20 l vodíka. Koľko tepla mu musíme dodať, aby sa
jeho tlak zvýšil z 5066,25kPa na
6079,5kPa? Vodík má molárnu hmotnosť
2.10 -3 kg.mol -1 a hmotnostnú tepelnú kapacitu 10130 J.kg -1.K -1.
( Q=49,383kJ )
8. Počas stláčania 5 l vzduchu
z počiatočného tlaku 101kPa sa
odovzdal okoliu 1kJ tepla. Aký mal
tlak a aký objem zaberal vzduch po stlačení, ak dej prebiehal izotermicky? (
p=731,88kPa, V=6,9.10 -4 m3 )
9. Akú prácu vykoná 2,5m3 vzduchu s teplotou 32°C a tlakom
455962Pa, keď sa adiabaticky rozopne tak,
že jeho teplota klesne na 15°C. Hmotnostná tepelná kapacita vzduchu je 728
J.kg -1.K -1 a
molárna hmotnosť je 28,45.10 -3 kg.mol -1. ( W=158,5kJ )