Odvodenie van der Waalsovej
stavovej rovnice
Objem častíc sa prejaví
takto: Častice v skutočnosti nemajú k dispozícii objem nádoby V ale objem (V-b), kde b je 4-násobok
súhrnného objemu častíc. Dostali sme korekciu stavovej rovnice ideálneho plynu na
objem častíc:
![]() (a)
(a)
0 E r r0
![]()
![]()
![]() Dvojica susedných častíc
plynu je mechanická sústava dvoch hmotných bodov s potenciálnou energiou,
ktorej závislosť od vzdialenosti medzi časticami je ukázaná na obr.
Dvojica susedných častíc
plynu je mechanická sústava dvoch hmotných bodov s potenciálnou energiou,
ktorej závislosť od vzdialenosti medzi časticami je ukázaná na obr.
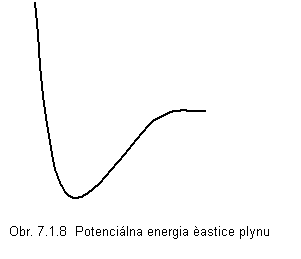
7.1.8. Vzdialenosť prislúchajúca minimu potenciálnej energie je rovnovážna
vzdialenosť. Ak sa častice dostanú do vzdialenosti r < r0 , sila medzi časticami je odpudivá, ak r > r0 sila pôsobiaca medzi časticami
je príťažlivá. Závislosť sily medzi časticami od ich vzájomnej vzdialenosti je
nesúmerná, častice sú oveľa dlhšiu dobu ďalej od seba ako je rovnovážna vzdialenosť,
a preto prevládajú v plyne príťažlivé sily medzi časticami. Prejavuje sa to
tak, ako by v plyne pôsobil navyše tlak pi
(tzv. vnútorný tlak), ktorý sa pridáva k tlaku, ktorým pôsobí plyn na steny
nádoby. Odhadneme vnútorný tlak.
Príťažlivé sily na
časticu, ktorá je ďalej od stien sa pri chaotickom pohybe rušia, pretože táto
častica je zo všetkých strán obklopená časticami, ktoré ju k sebe
priťahujú. Situácia inakšie vyzerá v tesnej blízkosti steny. Na vrstvu častíc
(označme ju A), ktorá je v priamom susedstve so stenou, pôsobia príťažlivé sily
od vrstvy častíc plynu, ktorá s ňou priamo susedí (vrstva B). Na vrstvu A
pôsobia teda príťažlivé sily len z jednej stranu (od steny nádoby nie), vrstva
A je vťahovaná dovnútra. Počet častíc vo vrstve A je úmerný koncentrácii n. Počet častíc vo vrstve B je tiež
úmerný n. Sila medzi vrstvami je
úmerná počtu častíc v oboch vrstvách, t.j. n2.
Vnútorný tlak úmerný tejto sile bude tiež úmerný n2. Koncentrácia sa zase rovná počtu častíc v nádobe
(ktorý je konštantný) delenom objemom nádoby, t.j. n = N/V a vnútorný tlak môžeme napísať ako
![]()
Stavová rovnica bude teraz vyzerať takto:
![]() (7.1.30)
(7.1.30)