Kapitola 7
KINETICKÁ
TEÓRIA PLYNU A TERMODYNAMIKA
__________________________________________________________________________
7.1 KINETICKÁ
TEÓRIA PLYNU
V tejto kapitole sa budeme zaoberať
ideálnym plynom. Za určitých okolností môžeme aj reálny plyn považovať za
ideálny. Reálne plyny pozostávajú z molekúl, sú však aj plyny
pozostávajúce z atómov (napr. hélium) a voľné elektróny v kove
tiež majú za určitých predpokladov vlastnosti ideálneho plynu (podľa klasickej
elektrónovej teórie). My budeme z dôvodov všeobecnosti hovoriť
o časticiach plynu. Častice ideálneho plynu si
môžeme predstaviť ako dokonale pružné guľôčky zanedbateľných rozmerov. Pohybujú
sa priamočiaro medzi dvomi zrážkami, smery pohybu sa menia pri zrážkach. Zrážky
medzi časticami sú dokonale pružné, takisto sú pružné aj zrážky častíc so
stenami nádoby. Medzi časticami niet vzájomného silového pôsobenia (t.j. niet
medzi nimi ani príťažlivých ani odpudivých síl). Na opisovanie pohybu častíc ideálneho
plynu používame zákony klasickej mechaniky.
Potrebné vedomosti
Na zvládnutie
tejto podkapitoly je potrebné ovládať základy dynamiky hmotného bodu,
a vedieť riešiť jednoduché integrály a diferenciálne rovnice.
Učebné ciele
Osvojiť si základné pojmy a poznatky, na
ktorých sa buduje kinetická teória ideálneho plynu. Študent z týchto
poznatkov má pochopiť odvodenie vzťahov pre tlak, energiu, prácu, voľnú dráhu
a rozdelenie častíc plynu podľa ich rýchlostí. Taktiež má získať predstavu
o prenosových javoch v ideálnom plyne.
Kľúčové slová
ideálny plyn, tlak plynu, vnútorná energia,
tepelná kapacita, práca plynu, voľná dráha, stavová rovnica plynu, Mawellovo
rozdelenie rýchlostí, prenosové javy
Predstavme si nádobu, v ktorej je plyn.
Častice plynu obsadzujú nádobu rovnomerne. Ak si nádobu myslene rozdelíme na
rovnaké oddelenia, ukáže sa, že v každom je približne rovnaký počet častíc
plynu. Ukážka možného obsadenia nádoby
s dvomi oddeleniami nás privádza k výsledku, že
najpravdepodobnejšie obsadenie oddelení je N/2,
kde N je celkový počet častíc
v nádobe.
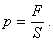
Pravdepodobnejšie sú také obsadenia oddelení, kde
sa počty častíc v jednom oddelení blížia k N/2
(o tom by sme sa presvedčili zostavovaním tabuliek pre väčšie a väčšie N). Pre veľký počet častíc je rovnaké
obsadenie oboch oddelení najpravdepodobnejšie, avšak nA = nB sa vyskytuje zriedkavo. Počet častíc v jednom oddelení jemne
kolíše okolo hodnoty N/2. Na obr.
7.1.1 je ukázané toto kolísanie počtu častíc v jednom oddelení ako funkcia
času. Toto jemné kolísanie hodnoty okolo najpravdepodobnejšej hodnoty nazývame
fluktuáciami. Občas sa vyskytne výrazná fluktuácia, obr. 7.1.2. Plyn po takejto
veľkej fluktuácii sa vráti späť do rovnovážneho stavu (kde je n = N/2) za určitú dobu, ktorú voláme
relaxačnou dobou. Takéto výrazné fluktuácie môžeme zaznamenať. Napr. príčinou
Brownovho pohybu (Brown sledoval pod mikroskopom peľové zrnko vo vode a zistil,
že sa pohybuje nepravidelne a trhane) sú takéto fluktuácie. Na obr. 7.1.3
je ukázaná trajektória peľového zrnka. Príčinou tohto pohybu sú nárazy častíc
prostredia (napr. molekúl H2O) na dostatočne malé teleso (napr.
peľové zrnko). Ak v nejaký okamih výrazne prevládne počet molekúl narážajúcich
na teleso z jednej strany (čo môžeme považovať za fluktuáciu), teleso sa týmto
smerom pohne. Nárazy častíc prostredia majú pôvod v ich tepelnom pohybe,
ktorý je chaotický. Preto Brownov pohyb telieska je tiež chaotický. Tento
pohyb, ako ukázali pokusy, závisí od teploty: čím je teplota prostredia vyššia,
tým je pohyb intenzívnejší. Iný dôkaz existencie tepelného pohybu molekúl
vzduchu poskytujú fluktuácie nulovej polohy zrkadlového galvanometra
(zrkadielko je upevnené na zvislom vlákne, ktoré je osou otáčania).
Nerovnomernosť nárazov molekúl na pravú, alebo ľavú stranu zrkadielka spôsobuje
jeho jemné otáčanie na obe strany. Graf uhlovej výchylky zrkadielka od času je
podobný obr. 7.1.1.

V tejto
úvodnej časti sme zistili z chovania sa častíc plynu, že hoci nemôžeme sledovať
každú časticu osobitne, jestvuje rovnovážna hodnota veličiny, ktorá
charakterizuje pohyb častíc. Táto veličina už má makroskopický charakter a môže
byť merateľná. Nazýva sa koncentrácia
častíc a vyjadruje počet častíc v jednotke objemu (hustota počtu častíc).
V prípade uvedenom vyššie by sme zistili, že koncentrácia plynu
(makroskopická veličina) je rovnaká v oboch oddeleniach nádoby. Kinetická teória plynu dáva do súvislosti makroskopické
parametre plynu s veličinami charakterizujúcimi vlastnosti a pohyb
jednotlivých častíc.
Kontrolné otázky
- Pokús sa zostaviť tabuľku pre N = 4
a zistiť, aké obsadenie oddelení je najpravdepodobnejšie a aká
je hodnota tejto pravdepodobnosti.
- Počet elektrónov emitovaných horúcim
povrchom kovu za jednotku času nie je prísne konštantný (pri ustálenej
teplote kovu). Aký je pôvod týchto fluktuácií?